- Autora Jason Gerald [email protected].
- Public 2023-12-16 11:00.
- Última modificació 2025-01-23 12:09.
La dilució és el procés per diluir una solució concentrada. Hi ha diverses raons per les quals algú pot voler fer una dilució, que va des de motius greus fins a simples. Per exemple, els bioquímics dilueixen les solucions a partir de les seves formes concentrades per obtenir noves solucions que s’utilitzen en experiments, mentre que, d’altra banda, els cambrers solen diluir licors amb refrescos o sucs per fer els còctels més saborosos. La fórmula general per calcular la dilució és C1V1 = C2V2, amb C1 i C2 representa les concentracions inicials i finals de la solució, respectivament, i V1 i V2 representa el volum.
Pas
Mètode 1 de 2: Dilució de concentrats amb precisió mitjançant l'equació de dilució

Pas 1. Determineu el que sabeu i el que no sabeu
La dilució en química sol significar prendre una petita quantitat d'una solució de la qual coneixeu la concentració, i després afegir un líquid neutre (com l'aigua) per obtenir una nova solució amb un volum més gran però una concentració més baixa. Això es fa molt sovint als laboratoris de química, perquè, per efectes, els reactius sovint s’emmagatzemen en concentracions molt elevades, que després es dilueixen per utilitzar-los en experiments. Normalment, en la majoria de situacions del món real, coneixereu la concentració de la vostra solució inicial i la concentració o volum que voleu que sigui la vostra concentració final, però no el volum de la solució inicial que necessiteu per obtenir la solució final.
- No obstant això, en altres situacions (especialment en problemes escolars), és possible que hagueu de trobar altres peces del trencaclosques, per exemple, se us pot donar un volum i una concentració inicials i, a continuació, se us demanarà que trobeu la concentració final si diluïu una solució. fins al volum desitjat. En qualsevol cas de dilució, és útil tenir en compte les variables conegudes i desconegudes abans de començar.
-
Acabem les preguntes d'exemple. Suposem que se’ns demana que diluïm una solució de 5 M amb aigua per obtenir 1 L d’una solució de 1 mM. En aquest cas, sabem la concentració de la nostra solució inicial i el volum i la concentració final que volem, però no la quantitat de solució inicial que hem d’afegir amb aigua per aconseguir el resultat desitjat.
Recordatori: en química, M és una mesura de concentració anomenada molaritat, que denota els mols d’una substància per litre
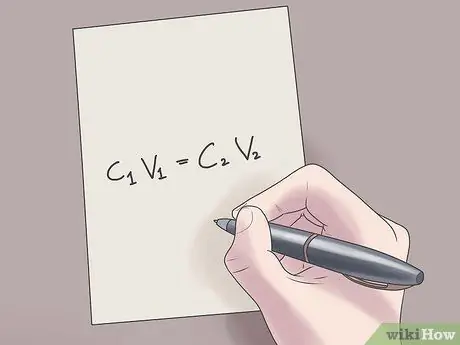
Pas 2. Connecteu els vostres valors a la fórmula C1V1 = C2V2.
En aquesta fórmula, C1 és la concentració inicial de la solució, V1 és el volum de la solució inicial, C2 és la concentració final de la solució i V2 és el volum de la solució final. Connectar els valors coneguts a aquesta equació us ajudarà a trobar valors desconeguts amb menys dificultats.
- Pot ser útil posar un signe d’interrogació davant de la unitat que vulgueu cercar per ajudar-vos a resoldre’l.
-
Continuem amb el nostre exemple. Introduirem els valors que coneixem de la següent manera:
- C1V1 = C2V2
- (5 M) V1 = (1 mM) (1 L). Les nostres dues concentracions tenen unitats diferents. Parem-nos aquí i passem al següent pas.

Pas 3. Tingueu en compte qualsevol diferència d’unitat
Com que les solucions impliquen canvis de concentració (que de vegades poden ser força grans), no és estrany que les dues variables de la vostra equació tinguin unitats diferents. Tot i que això és fàcil d’obviar, les unitats desiguals de la vostra equació poden fer que la vostra resposta sigui incorrecta. Abans d’acabar, converteix tots els valors amb unitats de concentració i / o volum diferents.
-
En el nostre exemple, utilitzem diferents unitats per a concentracions de M (molars) i mM (milimolars). Canviem la nostra segona mesura per M:
- 1 mM × 1 M / 1.000 mM
- = 0,001 M

Pas 4. Finalitzar
Un cop totes les unitats siguin iguals, resol la vostra equació. Això es pot fer gairebé sempre amb àlgebra simple.
-
Aquí deixem el nostre exemple de problema: (5 M) V1 = (1 mM) (1 L). Anem a trobar el valor de V1 amb la nostra nova unitat.
- (5 M) V1 = (0,001 M) (1 L)
- V1 = (0,001 M) (1 L) / (5 M).
-
V1 = 0,0002 L o 0,2 ml.

Pas 5. Compreneu com s'utilitza correctament la resposta
Suposem que heu trobat el valor que us falta, però no esteu segur de com utilitzar aquesta nova informació en la dilució real que heu de fer. Això és comprensible: el llenguatge de les matemàtiques i les ciències de vegades no coincideix amb el món real. Quan conegueu els quatre valors de l’equació C1V1 = C2V2, feu la dilució de la següent manera:
- Mesureu el volum V1 a partir d’una solució amb una concentració de C1. A continuació, afegiu el diluent suficient (aigua, etc.) per fer el volum total V2. Aquesta nova solució tindrà la concentració desitjada (C2).
- En el nostre exemple, per exemple, primer mesurem 0,2 mL d’una solució de 5 M. A continuació, afegirem prou aigua per augmentar el volum de la solució a 1 L: 1 L - 0,0002 L = 0,9998 L, o 999, 8 mL. En altres paraules, afegirem 999,8 ml d'aigua a la nostra solució de mostra petita. La nostra nova solució diluïda té una concentració d’1 mM, que és la nostra concentració desitjada.
Mètode 2 de 2: fer una solució de dilució senzilla i pràctica

Pas 1. Llegiu qualsevol embalatge per obtenir informació
Hi ha diversos motius pels quals és possible que vulgueu preparar una solució de dilució a casa, a la cuina o en un altre laboratori no químic. Per exemple, fer suc de taronja a partir d’un concentrat simple és una dilució. En molts casos, el producte que cal diluir conté informació sobre la dilució que cal fer, en algun lloc de l’embalatge. És possible que tinguin instruccions precises a seguir. A continuació, es detallen algunes coses que cal tenir en compte quan es busca informació:
- Volum de producte utilitzat
- Volum de diluent utilitzat
- Tipus de diluent utilitzat (generalment aigua)
- Instruccions especials de mescla
- És possible que no vegeu informació sobre la concentració exacta del líquid utilitzat. Aquesta informació no és útil per al consumidor mitjà.

Pas 2. Afegiu la substància que actua com a diluent a la solució concentrada
Per a dilucions domèstiques simples, com les que podeu fer a la cuina, realment només heu de conèixer el volum de concentrat que utilitzeu i la concentració final aproximada que voleu abans de començar. Diluïu el concentrat amb una quantitat adequada de diluant, que es determina en funció del volum del concentrat inicial utilitzat. Mirar abaix:
- Per exemple, si volguéssim diluir 1 tassa de suc de taronja concentrat a 1/4 de la seva concentració inicial, afegiríem 3 tasses aigua al concentrat. La nostra mescla final tindrà 1 tassa de concentrat en 4 tasses de líquid sencer, 1/4 de la seva concentració inicial.
- Heus aquí un exemple més complicat: si volguéssim diluir 2/3 tassa de concentrat a 1/4 de la seva concentració inicial, afegiríem 2 tasses d’aigua, perquè 2/3 tassa equival a 1/4 vegades 2 i 2/3 tassa de la líquid sencer.
- Assegureu-vos d’afegir la substància a un recipient prou gran com per contenir el volum final que vulgueu: un recipient gran o un recipient similar.

Pas 3. Ignoreu el volum de pols en la majoria dels casos
L’addició d’una pols (com ara certes mescles de begudes) a un líquid normalment no es considera una dilució. El canvi de volum resultant de l'addició d'una petita quantitat de pols al líquid sol ser prou petit per ser insignificant. Dit d’una altra manera, quan afegiu una petita quantitat de pols a un líquid, només cal afegir la pols al volum final de líquid desitjat i barrejar.
Advertiment
- Seguiu totes les directrius de seguretat proporcionades pel fabricant o requerides per la vostra empresa. Això és especialment important si heu de diluir la solució àcida.
- Treballar amb solucions àcides pot requerir mesures i pautes de seguretat més detallades que amb solucions no àcides.






